Ásványtani alapadatok
A kalcit a Mohs-féle keménységi skála harmadik tagja: Mohs-keménysége 3, vagyis körömmel már nem, de tûvel könnyen karcolható. A kalcit gyakori ásvány, többnyire színtelen vagy fehér, máskor halványsárga, de vörös és akár fekete is lehet. A víztiszta, színtelen kalcitváltozat a leghíresebb lelõhely után "izlandi pát" néven ismert.
Szilárd ionos vegyület, amely Ca2+ (kalcium) kationokból és CO32- (karbonát) összetett anionokból épül fel.
A kalcit a háromszöges (trigonális) kristályrendszerben kristályosodik, formagazdag ásvány, kristályai lehetnek lemezek, torzult kockára emlékeztetõ romboéderek, vagy akár tû alakúak is. A kalcit hasadása kitûnõ: három egyenrangú hasadási iránya van, ezek nem derékszöget zárnak be egymással, így a hasadási idom nem kocka, hanem paralelepipedon lesz.
A kalcit változatos körülmények között képzõdhet: forró- és hidegvizes oldatokból, édes- vagy sós vízbõl egyaránt kristályosodhat. Éppen ezért jelen van hétköznapjainkban is: a meleg vizet használó berendezéseken (vízforraló, mosógép, zuhanyrózsa) kiváló vízkõ fõ alkotója. A vízkõ ellen az ecetet hívhatjuk segítségül, ugyanis a kalcit már gyenge savas közegben is oldódik. Az oldódás során szén-dioxid gáz (CO2) keletkezik, amit buborékok fejlõdése jelez.
Nézzen kalcitkristályokat galériánkban! Halványsárga kalcitkristály
Mész, mészkõ, égetett mész, oltott mész
A mész kifejezés a latin calx szóból származik, és különbözõ Ca-vegyületeket értettek/értenek alatta.
A mészkõ fõként kalcitból (trigonális kristályrendszerû CaCO3) álló kõzet. Az apróra tört mészkõbõl égetéssel (kalcinálással) nyerik az égetett meszet (kalcium-oxid, CaO; a folyamat: CaCO3 + hõ => CaO + CO2). Ha az égetett mészhez vizet keverünk, heves reakció közben oltott mész, vagyis kalcium-hidroxid (Ca(OH)2) keletkezik. Az oltott mész lassan felveszi a levegõbõl a szén-dioxidot és újra kalcit keletkezik (Ca(OH)2 + CO2 => CaCO3 +H2O). Régen a habarcs mindössze homok, (oltott) mész és víz keveréke volt, és az építkezésnél a ragasztó szerep éppen a kalcit kristályosodásából adódott. Középkori váraink, templomaink köveit ma is e kalcit fogja össze.
CaCO3 - az élõvilág is "mészbõl" építkezik
A Ca2+ a tengervíznek harmadik, az édesvíznek sok esetben leggyakoribb kationja. A levegõ széndioxid-tartalma szénsavként (H2CO3) oldódik a vízben, amibõl azután hidrogén-karbonát anion (HCO3-) ill. karbonát anion (CO32-) képzõdhet:
CO2 (gáz) + H2O <=> H2CO3 <=> HCO3- + H+ <=> CO32- + 2H+
Mind az édesvízben, mind a sós tengervízben adottak tehát CaCO3 alkotói (Ca2+ kation és CO32- összetett anion), ezért a CaCO3 könnyen kiválik/kiválasztható vizes oldatból. Éppen ezért sok élõlény külsõ vagy belsõ szilárd váza is "mészbõl" van, CaCO3 anyagú.
A CaCO3 kémiai összetétel többféle kristályszerkezettel párosulhat: a kalcit, az aragonit és a vaterit is CaCO3 összetételû ásványok. Ezt a jelenséget egy szilárd vegyület többalakúságának (polimorfia) nevezzük. Az élõvilágban a kalcit- és az aragonitváz a gyakori (az aragonitot sorozatunk egy késõbbi részében mutatjuk be).
Az élõlények által kiválasztott vázon nem látható a kristályok alakja, nem állapíthatjuk meg szabad szemmel, hogy trigonális rendszerû kalcitról vagy rombos kristályrendszerû aragonitról van-e szó. Ilyenkor a (talknál már bemutatott) röntgen-pordiffrakciót hívhatjuk segítségül: a tojás-, kagylóhéj vagy éppen éti csiga házának egy darabját porrá törjük, és a röntgensugárzás segítségével informálódunk kristályszerkezetérõl. A leghétköznapibb példa kalcitra a tyúktojás héja, egyes kagylók vagy a tengeri sünök váza és tüskéi. A tengeri élõlények vázának anyaga sokszor függ a tengervíz hõmérsékletétõl: meleg, trópusi vizekben inkább az aragonitváz a jellemzõ (pl. korallok), hideg vízben a kalcit. A szárazföldön az éti csiga aragonitból építi a házát.
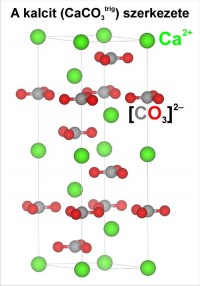
A kalcit szerkezete.
A szürkével jelölt szénatomot háromszög alakban veszik körül a pirossal jelölt oxigénatomok. A szerkezetben a [CO3]2- karbonát anionok és a Ca2+ kalcium kationok (zöld) felváltva vízszintes síkokba rendezõdnek
Kalcit - mészkõ, márvány
A tengerben parányi mészvázú egysejtûek milliói is élnek. Mészvázuk törmelékébõl mésziszap lesz, amely idõvel kõzetté szilárdul. A döntõen kalcitból álló üledékes kõzet a mészkõ. A mészkõ nagy mélységben, nagy nyomás hatására átkristályosodhat, márvány lesz belõle. A márvány ugyanúgy kalcitból áll, mint a mészkõ, csak nagyobbak benne a kalcitkristályok. Mind a mészkõ, mind pedig a márvány igen kedvelt építõ- és díszítõkõ. Édesvízben képzõdött, sárgásfehér, lyukacsos mészkõbõl (szaknyelven travertino) épült például a Parlament, a Halászbástya és a Mátyás-templom.
Egy másik jellegzetes építõkõ a tengervízben képzõdött, tömör vörös mészkõ, amely igen gyakran tartalmaz csigára emlékeztetõ, olykor több tíz centiméteres õsmaradványokat, ún. ammoniteszeket. Ilyen vörös mészkõbõl készült az 1000 Ft-os bankjegyen is látható Herkules-kút Mátyás király idején a Visegrádi palotában, de sok középületben, postán, aluljáróban is találkozhatunk vele járókõként, falburkolatként.
A kalcit könnyen képzõdik és könnyen oldódik is: ezért karsztosodhat a mészkõ, így képzõdnek a mészkõben a cseppkõbarlangok. A cseppkõ anyaga is kalcit.
"Kettõslátás" alkohol nékül
Izladi pát hasadási idom. Az idom leghosszabb éle 3,5 cm. A példány Szibériából, Oroszországból származik, ahol a 20. század második felében az izlandi pátot optikai felhasználásra bányászták
A fentin képen egy "tökéletes" kalcit egykristályból hasítással elõállított idom látható. Jól megfigyelhetõ a kalcit optikai kettõs törése: a kristály alá tett papírlap felirata megkettõzõdve látszik. Ennek oka, hogy a kalcitba lépõ fénysugár kettéválik. A kristályt körbeforgatva a papírlapon az egyik felirat helyben marad, a másik elmozdul, kört ír le. A kalciton áthaladó mindkét fénysugár jellemzõ tulajdonsága, hogy síkban polarizált, ezért az izlandi pátot régebben polarizált fénysugár elõállítására is használták.
Polarizált fényt a kõzettani, ún. polarizációs mikroszkópban használunk az ásványok vizsgálatára. Az izlandi pátból készült nikol-prizmát a fénysugár útjába helyezve polarizált fényt kapunk, amivel jól vizsgálhatók az ásványok. Hogy mégse kettõs, "részeges" képet lássunk a mikroszkópban, a kalciton áthaladó két fénysugár közül az egyiket (amelyik nem forgatja körbe a feliratot) kizárták a mikroszkópból a teljes visszaverõdés segítségével.
Mára az izlandi pátból készült nikol-prizmát modernebb optikai eszközök váltották fel a polarizációs mikroszkópokban.
* * *
Szómagyarázat
háromszöges (trigonális) kristályrendszer: A kristályrendszerre jellemzõ minimális szimmetria egy 120o-os forgástengely (trigir).
hasadás: Ha egy ásványt megütve az síklapok mentén válik ketté, az ásvány hasad. (Ha az elválás egyenetlen felszín mentén történik, az ásvány törik.)
kristályrendszer: A kristályos anyagok térbeli (háromdimenziós), rendezett kristályrácsában szabályos ismétlõdéseket (szimmetriát) találunk. Ez a belsõ szimmetria a kristályok külsõ alakjában is tükrözõdhet. A kristályok alaktani (kristálymorfológiai) jellemzésére e szimmetriákat tudjuk felhasználni. A szemmel is észlelhetõ szimmetriaelemek (síkra tükrözés, tengelyek szerinti forgatások, középpontra tükrözés) alapján a kristályokat 7 kristályrendszerbe soroljuk. Ezek rendre a háromhajlású (triklin), egyhajlású (monoklin), rombos, háromszöges (trigonális), négyszöges (tetragonális), hatszöges (hexagonális) és szabályos (köbös). A kristályrendszer jellemzõ szimmetriaelemei határozzák meg, hogy az ásvány kristályrácsa milyen koordinátarendszerben írható le ("kristálytani tengelyek").
polimorfia: többalakúság, szilárd vegyület esetében az azonos kémiai összetétel többféle kristályszerkezettel valósulhat meg. Példák: C - a szén polimorf módosulatai a hexagonális kristályrendszerû grafit (Chex) és a szabályos kristályrendszerû gyémánt (Cszab); CaCO3 - két gyakori polimorf módosulata van: a kalcit trigonális kristályrendszerû (CaCO3trig), az aragonit rombos kristályrendszerû (CaCO3romb).
romboéder: kristályforma, amely 6 darab rombusz alakú kristálylapból áll. Úgy képzelhetjük el legegyszerûbben, hogy egy kockát valamelyik testátlója mentén összenyomunk vagy megnyújtunk.
rombos kristályrendszer: A kristályrendszerre jellemzõ minimális szimmetria három darab, egymásra merõleges, 180o-os forgástengely (digir), vagy két darab, egymásra merõleges tükörsík.
* * *
Az ELTE Ásvány-és Kõzettár elérhetõségei
1117 Budapest, Pázmány Péter sétány 1/C (földszint) - az ELTE Lágymányosi campusának déli, a Lágymányosi híd felé esõ épülete
Telefon: (1) 381 22 08
nhm@ludens.elte.hu
Nyitva tartás:
Az egyetemi szorgalmi idõszakban (szeptember-december, február-május) hétfõ, szerda, péntek: 10-16.
Minden hónap utolsó vasárnapján: 10-16.
Más idõpontokban is fogadnak csoportokat elõzetes egyeztetéssel.
Belépõk:
Teljes árú: 400 Ft
Kedvezményes (diák, nyugdíjas): 200 Ft
Családi jegy: 800 Ft
Csoportos jegy (minimum 10 fõ): 2000 Ft
Díjtalan a belépés 6 éven alul és 65 év felett, mozgássérülteknek (+1 fõ kísérõnek), valamint ELTE-s diákoknak és dolgozóknak
Tárvezetés (csak elõre bejelentett csoportoknak, maximum 40 fõ):
Magyarul: 1500 Ft
Angolul, németül: 3000 Ft
[origo]
Kovács Pál